Центр клинических исследований ГБУЗ «Эндокринологический диспансер ДЗМ»
Клинические исследования проходят на базе ГБУЗ «Эндокринологический диспансер ДЗМ» в отделение обучения и лечения диабета и отделение диабетическая стопа.
Исследовательский опыт – 22 года. Руководит центром д.м.н.проф. Анциферов М.Б.
В диспансере осуществляется организация по проведению клинических исследований, подготовка и проведение спонсируемых/поддерживаемых клинических исследований разных фаз (II-IV) по профилю эндокринология с акцентом на разные типы сахарного диабета и ожирение.
В рамках клинических исследований пациенты имеют возможность бесплатно получить инновационное лечение дорогостоящими лекарственными препаратами, комплексное обследование и наблюдение как в период проведения исследования, так и после него.
Сотрудники – квалифицированные специалисты c длительным стажем работы в области клинических исследований лекарственных препаратов, имеют сертификаты ICH GCP E6 v2.0 (Good Clinical Practice).

Котешкова Ольга Михайловна – Заведующий отделением обучения и лечения диабета, врач – эндокринолог.

Ермакова Екатерина Александровна – к.м.н. врач – эндокринолог.

Молина Людмила Петровна – к.м.н. врач – кардиолог.

Репетунов Георгий Алексеевич – врач – эндокринолог.

Анциферова Дарья Михайловна – врач – эндокринолог.

Ромашкина Лада Павловна – врач- эндокринолог.

Анциферов Михаил Борисович – Президент ГБУЗ «Эндокринологический диспансер департамента здравоохранения города Москвы», проф.,д.м.н. Участвует в клинических исследованиях более 20 лет, являлся главным исследователем более чем 60-ти исследований. Область исследований – эндокринология.
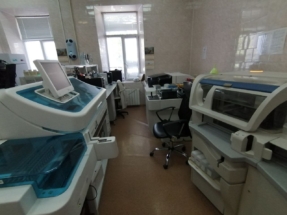
Клинико-диагностическая лаборатория с экспресс отделом.
Многопрофильная лаборатория, оснащенная современным автоматизированным оборудованием и новейшими технологиями ведущих мировых компаний (Roche Diadnostics, Beckman Coulter, Instrumentation Laboratory). Выполняются свыше 1000 лабораторных исследований опытными высококвалифицированными специалистами. Лаборатория функционирует 7 дней в неделю, обеспечивая непрерывный цикл диагностических исследований.
Большое внимание уделяется качеству выполняемых исследований. Лаборатория участвует в российских (ФСФОК) и международных (RIQAS, EQAS) программах по контролю качества, в том числе основанных на онлайн сравнении многих международных ведущих лабораторий (BioRAD Unity Real Time) позволяющем объединить внутрилабораторный и межлабораторный контроль.
Для обеспечения качественного бесперебойного производственного цикла, выполняются все необходимые работы по периодическому плановому техническому обслуживанию и метрологической поверке всех технических устройств и оборудований.
Спектр медицинских анализов включает:
- гематологические и общеклинические исследования
- исследование гемостаза
- биохимический исследования
- иммунологические исследования
- цитологические исследования
- иммуноцитохимические исследования
- ПЦР-диагностика
| Оборудование клинико-диагностической лаборатории ГБУЗ “Эндокринологический диспансер ДЗМ” | ||
| № | Наименование оборудования | Количество |
| 1 | Автоматический анализатор мочи- «AUTION MAX AX-4280» | 1 |
| 2 | Автоматический анализатор мочи (микроскопия) – «IQ 200 Iris» IRIS Diagnostics | 1 |
| 3 | Гематологический анализатор – MINDRAY BC- 6800 | 1 |
| 4 | Автоматический роторный анализатор показателей гемостаза – ELIT PRO | 1 |
| 5 | Анализатор гликозилированного гемоглобина – Variant II turo | 1 |
| 6 | Анализатор гликозилированного гемоглобина – «D10» | 1 |
| 7 | Анализатор СОЭ-метр – MixRate | 1 |
| 8 | Автоматический биохимический анализатор – «Konelab Prime 60i» | 1 |
| 9 | Автоматический биохимический анализатор – ABX Pentra 400 | 1 |
| 10 | Автоматический иммуноферментный анализатор – Personal Lab | 1 |
| 11 | Иммуноферментный хемилюминесцентный анализатор – «ADVIA Centauer XP» | 1 |
| 12 | Хемилюминесцентный автоматический анализатор – IMMULITE 2000 | 1 |
| 13 | Иммуноферментный хемилюминесцентный анализатор – «LIAISON» | 1 |
| 14 | Иммуноферментный электрохемилюминесцентный анализатор – Cobas e 411 | 1 |
| 15 | Иммуноферментный хемилюминесцентный анализатор – «Access2» | 1 |
| 16 | Анализатор глюкозы – «BIOSEN С Line» | 1 |
| 17 | Анализатор глюкозы – «BIOSEN S Line» | 1 |
| 18 | Анализатор глюкозы – «BIOSEN 5030» | 1 |
| 19 | Автоматический биохимический анализатор – MINDRAY BS-600 | 1 |
| 20 | Анализатор электролитного состава крови – AUDICOM AC – 9000 | 1 |
Документация и препараты хранятся в отделениях, которые проводят клинические исследования.
Оснащение: шкафы для хранения документации, холодильники для препаратов.
Места для хранения материалов исследования — имеются.
Места хранения исследуемого препарата — имеются.
Обеспечение холодовой цепи, контроль температуры и влажности проводится.
Хранение материала в соответствии с требованиями производителя.
Отдельное помещение архива документации исследовательского центра, обеспечение доступа в помещение ограничено.
Места для амбулаторных клинико-диагностических исследований имеются.




Эндокринология
Регуляторные документы РФ
Федеральные законы
- Федеральный закон от 12.04.2010 года № 61-ФЗ “Об обращении лекарственных средств”
- Налоговый кодекс Российской Федерацией (извлечения), размеры государственной пошлины
- Федеральный закон от 21 ноября 2011 г. N 323-ФЗ “Об основах охраны здоровья граждан в Российской Федерации” (извлечения)
Постановления Правительства РФ
- Постановление Правительства РФ от 01.06.2021 № 853 “Об утверждении Правил ввоза лекарственных средств для медицинского применения в Российскую Федерацию и признании утратившими силу некоторых актов и отдельных положений некоторых актов Правительства Российской Федерации”
- Постановление Правительства РФ от 13.09.2010 № 714 (ред. от 15.10.2014) «Об утверждении типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата»
- Постановление Правительства РФ от 3 сентября 2010 г. №673 “Об утверждении Правил ввоза на территорию Российской Федерации и вывоза за пределы территории Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения”
- Постановление Правительства от 15 сентября 2008 г. N 688 “Об утверждении перечней кодов медицинских товаров, облагаемых налогом на добавленную стоимость по налоговой ставке 10 процентов”.
Приказы
- Приказ Федеральной службы по надзору в сфере здравоохранения от 19. 02.2022 № 1185 «Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федерально службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств»
- Приказ Минздрава РФ от 25.08.2021 № 880н “Об утверждении Административного регламента Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения на общем рынке лекарственных средств в рамках Евразийского экономического союза и (или) Российской Федерации, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией”
- Приказ Минздрава РФ от 11 января 2021 г. № 4 “О составе Совета по этике”
- Приказ Минздрава России от 29.10.2019 N 900н “Об утверждении Административного регламента Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по выдаче заключений (разрешительных документов) на ввоз на территорию Российской Федерации и вывоз за пределы территории Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения”
- Приказ Минздрава России от 07.05.2018 N 202н “Об утверждении Порядка размещения информации о составе Совета по этике, планах его работы и текущей деятельности на официальном сайте Министерства здравоохранения Российской Федерации в информационно-телекоммуникационной сети “Интернет” и о признании утратившим силу пункта 22 Положения о Совете по этике, утвержденного приказом Министерства здравоохранения Российской Федерации от 29.11.2012 г. N 986н”
- Приказ Минздрава России от 19.01.2018 N 20н “Об утверждении Административного регламента Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по выдаче разрешения на проведение клинического исследования лекарственного препарата для медицинского применения”
- Приказ Минздрава РФ от 24.08.2017 г. № 558н “Об утверждении Правил проведения экспертизы лекарственных средств для медицинского применения и особенности экспертизы отдельных видов лекарственных препаратов для медицинского применения (референтных лекарственных препаратов, воспроизведенных лекарственных препаратов, биологических лекарственных препаратов, биоаналоговых (биоподобных) лекарственных препаратов (биоаналогов), гомеопатических лекарственных препаратов, лекарственных растительных препаратов, комбинаций лекарственных препаратов), форм заключений комиссии экспертов”
- Приказ Федеральной службы по надзору в сфере здравоохранения от 15 февраля 2017 г. № 1071 “Об утверждении порядка осуществления фармаконадзора”
- Приказ Минздрава РФ от 1 апреля 2016 г. № 200н “Об утверждении правил надлежащей клинической практики”
- Приложение 13 к Приказу Минпромторга России от 14.06.2013 N 916 (ред. от 18.12.2015) Об утверждении правил надлежащей производственной практики – лекарственные препараты для клинических исследований
- Приказ Минздрава РФ №986н от 29.11.2012 Об утверждении Положения Совета по этике
- Приказ Минздравсоцразвития РФ от 02.11.2010 N 951н “Об утверждении формы реестра выданных разрешений (решений об отказе в выдаче разрешений) на ввоз на территорию Российской Федерации и вывоз за пределы территории Российской Федерации биологических материалов (образцы биологических жидкостей, тканей, секретов и продуктов жизнедеятельности человека, физиологических и патологических выделений, мазков, соскобов, смывов, микроорганизмов, биопсийный материал), полученных при проведении клинического исследования лекарственного препарата для медицинского применения”
- Приказ Минздравсоцразвития России от 23 августа 2010 г. N 703н г. “Об утверждении формы сообщения о завершении, приостановлении или прекращении клинического исследования лекарственного препарата для медицинского применения”
- Приказ Минздравсоцразвития России № 775н от 31 августа 2010 г. “Об утверждении порядка рассмотрения сообщения о необходимости внесения изменений в протокол клинического исследования лекарственного препарата для медицинского применения”
- Приказ Минздравсоцразвития России от 26 августа 2010 г. №752н «Об утверждении порядка опубликования и размещения на официальном сайте Министерства здравоохранения и социального развития Российской Федерации в сети «Интернет» перечня медицинских организаций, имеющих право проводить клинические исследования лекарственных препаратов для медицинского применения»
- Приказ Минздравсоцразвития России №753н от 26 августа 2010 г. “Об утверждении порядка организации и проведения этической экспертизы возможности проведения клинического исследования лекарственного препарата для медицинского применения и формы заключения совета по этике”
Международная нормативная база
CLINICAL SAFETY DATA MANAGEMENT: DEFINITIONS AND STANDARDS FOR EXPEDITED REPORTING E2A
STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS E3
Интегрированное дополнение к ICH E6(R1): Руководство по надлежащей клинической практике E6(R2)
Хельсинкская декларация Всемирной медицинской ассоциации
Национальный стандарт
Клинические исследования в Москве
Министерство здравоохранения РФ
Государственный реестр лекарственных средств
Реестр выданных разрешений на проведение клинических исследований лекарственных препаратов
Реестр исследователей, проводящих клинические исследования лекарственных препаратов
Association of Clinical Research Organizations (ACRO )
A service of the U.S. National Institutes of Health
U.S. Food and Drug Administration (FDA)
Данные локального этического комитета:
ФИО председателя: Дорофеева Лариса Григорьевна,
Контактный телефон: 8-499-246-69-61,
График работы: Каждую 3 пятницу месяца с 15:00,
Адресс месторасположения: 119034, г. Москва, ул. Пречистенка д.37, стр .1,
Адрес электронной почты: ed@zdrav.mos.ru
Приказ от 21.02.2005 г. № 8 “О создании в Эндокринологическом диспансере Этического комитета”
Данные Московского городского этического комитета:
ФИО председателя: Журавлева Марина Владимировна
Телефон: 8-495-915-72-64
Адрес месторасположения: 115088, г. Москва,
ул. Шарикоподшипниковская, д. 9
Адрес электронной почты: ec@zdrav.mos.ru
Приказ от 25.11.2016 г. № 948 «О Московском городском независимом этическом комитете» на базе Государственного бюджетного учреждения города Москвы «Научно-исследовательский институт организации здравоохранения и медицинского менеджмента Департамента здравоохранения города Москвы».
(Приложение к приказу от 25.11.2006 № 948)
Клиническое исследование – научное исследование, в котором принимают участие лица с целью оценки эффективности и безопасности лекарственного препарата или расширения показаний к применению уже известного лекарственного препарата. Данная процедура является неотъемлемым этапом разработки лекарственного препарата, которая предшествует его регистрации и медицинскому применению. Все клинические исследования проводятся с соблюдением законодательства Российской Федерации (Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств», приказа Минздрава России от 01.04.2016 № 200н «Об утверждении правил надлежащей клинической практики», Национального стандарта ГОСТ Р 52379-2005 «Надлежащая клиническая практика» и др.), решений ЕАЭС, Хельсинской декларации Всемирной медицинской ассоциации и правил надлежащей клинической практики GCP (GCP– Good Clinical Practice «Надлежащая клиническая практика»). Следование правилам позволяет гарантировать, что права участвующих в исследовании пациентов защищены, а результаты исследования достоверны.
Современная медицина и фармация активно развиваются, помогая увеличить продолжительность и качество жизни людей. Клинические исследования являются важнейшей частью разработки новых препаратов. Исследования дают возможность понять, насколько препарат эффективен, безопасен, позволяют узнать его побочные эффекты и влияние на организм. Инициаторами проведения клинических исследований в большинстве случаев являются фармацевтические и биотехнологические компании, которые непосредственно участвуют в разработке и анализе изучаемого лекарственного препарата. Фармацевтические компании вправе подать заявку на регистрацию препарата только по окончании клинического исследования, сбора необходимых данных и всестороннего анализа их результатов. Препарат может получить отказ в регистрации, если: его действие было признано недостаточно эффективным; препарат оказался небезопасен для человека; компания предоставила неполный или недостоверный пакет информации о результатах клинического исследования. Благодаря клиническим исследованиям ученые улучшают знания о заболевании, продвигаясь в поиске эффективных и безопасных методов его лечения. Если результаты исследований подтверждают эффективность и безопасность препарата, он получает регистрацию на территории страны и врачи могут назначать данный препарат для лечения и профилактики заболеваний.
Принимая участие в клинических исследованиях, участники могут узнавать о новых методах лечения заболеваний до того, как они станут широко доступными. Тем самым, появляется возможность получать самую передовую медицинскую помощь в лечении заболевания и способствовать развитию медицины в целом.
В клинических исследованиях могут принимать участие пациенты и здоровые добровольцы, соответствующие критериям включения, не имеющие критериев исключения, указанных в протоколе исследования. Как правило, в исследованиях могут участвовать только пациенты с определенным заболеванием, для лечения которого и предназначен исследуемый препарат. Набор здоровых добровольцев возможен только в I фазе исследования, когда препарат применяется у человека впервые.
В клинических исследованиях могут принимать участие пациенты и здоровые добровольцы, соответствующие критериям включения, не имеющие критериев исключения, указанных в протоколе исследования. Как правило, в исследованиях могут участвовать только пациенты с определенным заболеванием, для лечения которого и предназначен исследуемый препарат. Набор здоровых добровольцев возможен только в I фазе исследования, когда препарат применяется у человека впервые.
Клинические исследования проходят в несколько этапов (фаз). Препарат переходит на следующую фазу исследования только в том случае, если он показал эффективность и безопасность на предыдущей.
В I фазе исследуемый препарат тестируется с участием небольшой группы людей – 20-80 человек. Врачи оценивают его токсичность, определяют безопасную дозировку и побочные эффекты.
В II фазе препарат изучается в группах 100-300 пациентов. Проверяется его эффективность при заболевании и детально выясняются риски его применения.
В III фазе исследования участие принимают уже несколько тысяч пациентов (1000-3000), чтобы на большей популяции подтвердить его эффективность, а также выявить возникающие побочные эффекты и сравнить со стандартными способами лечения.
IV фаза – исследования, которые проводятся уже после регистрации препарата. Их целью является получение дополнительной информации о безопасности, эффективности и оптимальном применении препарата.
Подробный план исследования описан в документе, который называется протокол исследования.
В протоколе указаны продолжительность исследования, критерии включения и исключения участников, расписание приема препаратов и т.д. Обязательно указывается перечень и расписание обследований, анализов и других процедур в рамках протокола клинического исследования. До начала исследования протокол должен пройти этическую экспертизу и получить одобрение Минздрава России, Этического комитета Минздрава России и локального этического комитета учреждения, где будет проводиться исследования.
Этические комитеты призваны на протяжении всего исследования контролировать безопасность участников исследования и следить за соблюдением их прав. Все изменения в протоколе, а также в документах, которые предназначены для пациентов, в обязательном порядке одобряются этическими комитетами. Врач знакомит пациента со всеми аспектами клинического исследования и, при согласии пациента и в случае соответствия пациента критериям включения и отсутствии критериев исключения, включает его в исследование. На протяжении всего исследования пациенты должны регулярно приходить в клинику согласно графику визитов для прохождения обследований и сдачи анализов. Эти процедуры необходимы для оценки эффективности препарата и безопасности пациента. Для правильного проведения исследования необходимо, чтобы все участники придерживались графика посещений, описываемого в протоколе исследования и в информированном согласии пациента. Частота и длительность посещений варьируется в зависимости от протокола исследования. Подписывая информированное согласие, пациент соглашается с предложенным графиком визитов. Многие исследования проводятся амбулаторно (в медицинском учреждении).
Информированное согласие – процедура добровольного подтверждения субъектом своего согласия на участие в конкретном исследовании после получения информации обо всех значимых для принятия им решения аспектах исследования. Информированное согласие документируется посредством подписания и датирования формы информированного согласия.
Перед тем, как пациент примет решение об участии в исследовании, ему предоставляют полную информацию о нем. После обсуждения врач предоставляет пациенту письменную форму, содержащую информацию об исследовании, в том числе о целях исследования, продолжительности, процедурах, возможных рисках и пользе и др. Пациент вправе подробно ознакомиться с информацией и обсудить решение об участии в исследовании с родственниками. Подписывая информированное согласие, пациент подтверждает, что ознакомлен с информацией об исследовании, что его согласие на участие является добровольным и осознанным. Пациент имеет право отказаться от участия в исследовании в любой момент без объяснения причин решения.
В зависимости от целей и сложности исследования его продолжительность может варьироваться от нескольких недель до нескольких лет. Сроки проведения исследования всегда оговариваются в протоколе. Этические комитеты наблюдают за ходом исследования вплоть до его окончания. В любой момент исследование может быть остановлено, если этический комитет сочтет, что оно небезопасно для участников.
Никто не имеет права принуждать пациента к участию в исследовании. Пациент имеет право в любой момент и без объяснения причин отказаться от участия в исследовании. Однако в некоторых случаях, например, если резкая отмена препарата представляет для здоровья пациента опасность, нельзя прекратить участие в исследовании немедленно.
Пациент имеет право на получение всей интересующей его информации, касающейся исследования, изучаемого препарата и состояния собственного здоровья в полном объеме и в доступной форме.
Контактная информация врача, проводящего исследование, содержится в информированном согласии.
Пациент имеет право на конфиденциальность своих личных данных. Вся информация о нем хранится в закодированном виде без возможности установления по ней его личности. Медицинская документация доступна ограниченному кругу лиц (врач, сотрудники компании-спонсора, контролирующие проведение исследования, аудиторы и уполномоченные государственные органы).
В ходе исследования пациент находится под постоянным врачебным наблюдением.
Каждый пациент имеет право на возмещение вреда здоровью, если будет установлено, что вред причинен в результате участия в клиническом исследовании.
Исследование проводится для того, чтобы получить ответы на конкретные научные вопросы. Крайне важно, чтобы пациент строго следовал всем инструкциям врача. Также пациент обязан сообщать врачу о симптомах, которые появились у него во время исследования, даже если они кажутся ему незначительными.
Прежде, чем препарат допускается к клиническим исследованиям, он должен пройти этап тщательного доклинического изучения (биомедицинские исследования, проводимые без участия человека в качестве субъекта, в большинстве случаев проводимые на лабораторных животных).
Все документы клинического исследования проходят строгую этическую экспертизу до начала исследования и в его процессе. Этические комитеты проверяют факты соответствия документов исследования этическим нормам, защищенности участников исследования, а также проводят оценку квалификации привлеченных к клиническому исследованию врачей.
На протяжении всего исследования состояние здоровья участников тщательно контролируется врачами: если состояние здоровья пациента ухудшится, он может быть выведен из исследования при возникновении необходимости; также ему будет оказана необходимая квалифицированная помощь.
В соответствии с законами Российской Федерации и международными стандартами приоритетом при проведении клинических исследований является безопасность и благополучие пациентов.
ГБУЗ «Эндокринологический диспансер ДЗМ» – единственное высокоспециализированное учреждение в системе Департамента здравоохранения города Москвы, оказывающее в амбулаторных условиях консультативно-диагностическую и лечебно-профилактическую помощь больным с эндокринными заболеваниями: с сахарным диабетом и его осложнениями, заболеваниями щитовидной железы, паращитовидных желез, аденомой гипофиза, заболеваниями надпочечников и другими эндокринными заболеваниями.
В Эндокринологическом диспансере применяются стационарозамещающие технологии с научно доказанной эффективностью и использованием уникального современного оборудования. Высоко-профессиональный коллектив и хорошая лабораторно-диагностическая база позволяют на амбулаторном уровне оказывать специализированную помощь в соответствии с современными стандартами, клиническими рекомендациями и международными руководствами.
Плановые показатели работы Эндокринологического диспансера за 2021 год.
Эндокринологический диспансер рассчитан на 420 посещений в смену.
За 2021г. выполнено:
– 107 385 врачебных посещений, что составило _____109,5____% от плана.
– 22 582 инструментально-диагностических исследований (УЗИ, ЭХО сердца, велоэргометрия, холтеровское исследование, рентгенологическое исследование), в том числе 751 тонкоигольных аспирационных биопсий щитовидной железы под ультразвуковым наведением,.
– 525 271 клинико-диагностических лабораторных исследований (гормональные исследования: ТТГ, св.Т4, св.Т3, АТкТПО, АТкТГ, АТк рец. ТТГ, кальцитонин, паратиреоидный гормон, АКТГ, пролактин, гормон роста, ИФР-1, кортизол в крови, кортизол в слюне, альдостерон, ренин, метанефрины, тестостерон, ЛГ, ФСГ, прогестерон, эстрадиол, ДГЭА-С, 17-ОН прогестерон, кальцитонин, маркеры остеопороза; а также общий анализ крови, общий анализ мочи, биохимический анализ крови, коагулологические исследования). КДЛ Эндокринологического диспансера имеет международные и общероссийские сертификаты качества на проводимые исследования.
– выполнено 330 законченных случаев лечения пациентов с эндокринными заболеваниями в условиях дневного стационара, что составило ___105,4___% от плана.
Места для хранения материалов исследования — имеются.
Места хранения исследуемого препарата — имеются.
Обеспечение холодовой цепи, контроль температуры и влажности проводится.
Хранение материала в соответствии с требованиями производителя.
Отдельное помещение архива документации исследовательского центра, обеспечение доступа в помещение ограничено.
Контактный телефон: 8-499-246-65-73